Os subtipos de IC possuem paisagens distintas de CNA (Extended Data Fig. 1j), mas sua paisagem e evolução de SV não foram investigadas. Aproveitando o ENiClust, descobrimos que o cenário genômico específico do subgrupo IC do câncer de mama é consistente ao longo da progressão da doença, apesar de um aumento da carga de alterações10,13,16,17 (Fig. 2a e Dados Estendidos Fig. 2a,b). Ambos HER2+ e pronto-socorro+ tumores primários e metastáticos de alto risco exibem aumentos acentuados característicos na carga de VS em seus respectivos loci recorrentemente amplificados (IC5: 17q12; IC6: 8p11; IC2: 11q13; IC1: 17q23). O pico da carga de VS em 17q12 (ERBB2) sugere que ERBB2 a amplificação é alimentada por alterações complexas, como ecDNA18. A carga mutacional no RE primário+ os tumores de risco típico foram mínimos (Fig. Complementar 1i), mas aumentaram na doença metastática (Fig. 2a), em parte devido ao tratamento (Dados Estendidos Fig. 2c). IC10 e IC4ER– os tumores exibem instabilidade difusa em todo o genoma com uma carga aumentada de VS, embora estes últimos apresentem um padrão atenuado e abriguem menos VS patogênicos e alterações nas vias de reparo do DNA, confirmando relatos anteriores19 (Dados Estendidos Fig. 2d, e). Nos locais metastáticos, a carga cumulativa de alterações foi maior nas metástases pulmonares e subcutâneas e menor nas recorrências de tecidos moles e na mama (Extended Data Fig. 2f). Estas alterações específicas do subgrupo foram observadas no DCIS (Extended Data Fig. 2a), enfatizando a dependência precoce do oncogene e os mecanismos de transformação maligna.
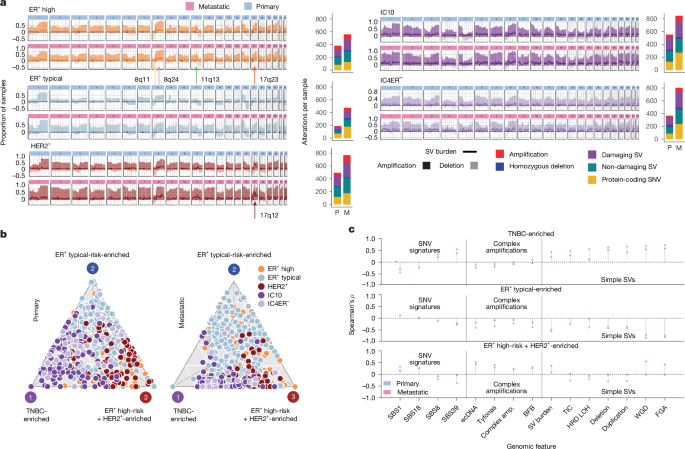
umPerfil CNA em nível de grupo IC (área sombreada; escuro indica amplificação, claro indica deleção) com carga de SV (linha) como sobreposição e carga de alteração total em amostras primárias e metastáticas. bProjeção frontal de Pareto no gráfico ternário de perfis de assinatura CNA e SV de tumores primários (esquerda) e metastáticos (direita) independentemente, resultando em três arquétipos genômicos. Cada círculo traçado representa um tumor. cGráficos de pirulito ilustrando a correlação entre características mutacionais e a distância para cada arquétipo. amp., amplificação; BFB, ruptura-fusão-ponte; TIC, cadeia de inserção modelada; LOH, perda de heterozigosidade; WGD, duplicação do genoma completo; FGA, fração do genoma alterada.
Em seguida, caracterizamos assinaturas CNA e SV em 702 tumores primários de mama, replicando os 24 CNA20 e 6 rearranjo8,21 assinaturas (RSs) relatadas anteriormente (Fig. Complementar 2a-c). RS3, RS5 (associado à deficiência de reparo homóloga (HRD); Figura 2d suplementar) e CN17 foram enriquecidos em tumores IC10, enquanto RS4, RS6 (associados a amplificações complexas) e CN7 foram enriquecidos em ER+ alto risco e HER2+ tumores (Dados Estendidos Fig. 2g, he Complementar Fig. 2e – g). pronto-socorro+ tumores de risco típico foram enriquecidos para CN1 (associados a genomas diplóides; Figura Complementar 2d, e).
Projetados em um plano bidimensional (Fig. Complementar 3a, b), os perfis arquitetônicos seguem um continuum e formam um poliedro que lembra a teoria ótima de Pareto, que ilustra compensações entre tarefas biológicas22. Os cânceres de mama primários são mapeados em três arquétipos genômicos dominantes (Fig. Complementar 3c-f): enriquecido com TNBC, ER+ enriquecido com risco típico e ER+ alto risco + HER2+-enriquecido. Os tumores dominados por um único processo mutacional são proximais a um vértice, enquanto aqueles caracterizados por múltiplos processos agrupam-se no centro (Fig. 2b e Dados Estendidos Fig. 2i). O arquétipo enriquecido com TNBC foi positivamente correlacionado com instabilidade genômica, SNVs de edição de HRD e APOBEC (Fig. 2c e Fig. Complementar 3g). Comparado ao pronto-socorro+ tumores de alto risco, HER2+ os tumores foram enriquecidos para tyfonas (Extended Data Fig. 2j). O pronto-socorro+alto risco + HER2+ O arquétipo enriquecido foi positivamente correlacionado com amplificações complexas, espécies reativas de oxigênio e SNVs associados a APOBEC abrigando co-amplificação de múltiplas citobandas (Extended Data Fig. 3a). Em contrapartida, o ER+ arquétipo enriquecido típico correlacionou-se negativamente com a maioria das características genômicas.
Tumores previstos como semelhantes ao BRCA com base na linha germinativa ou em características genômicas somáticas23 mapear para o arquétipo enriquecido com TNBC (Extended Data Fig. 3b). Na verdade, tanto o ER semelhante ao BRCA1 quanto o semelhante ao BRCA2+ e pronto-socorro– tumores demonstraram pontuações de arquétipo TNBC significativamente mais altas do que tumores não-HRD e ER semelhante a HRD+os tumores de alto risco estavam mais próximos do arquétipo enriquecido com TNBC do que os seus homólogos não semelhantes a HRD (OR = 5,09; P= 6,5 × 10−4 ). Além disso, os padrões mutacionais de ER semelhante a BRCA1 e semelhante a BRCA2– e pronto-socorro+ os tumores eram altamente concordantes (Fig. Complementar 3h, i). Notavelmente, enquanto 43,6% dos tumores TNBC eram semelhantes a HRD, 13,2% dos tumores ER+ também foi previsto que tumores de alto risco fossem semelhantes a HRD, sendo a maioria ER+IC1 ou IC9 de alto risco (OR = 4,43; P= 0,03; Dados Estendidos Fig. 3c e Figura Complementar 3j). Na verdade, embora as inversões de foldback e pyrgos tenham sido enriquecidas em TNBC (inversão de foldback: 17,3%, P= 2,00 × 10−3; pirgos: 18,8%, P= 9,33 × 10−4 ), esses eventos mutacionais também foram observados em ER+ tumores (5,1% e 4,1%, respectivamente; Dados Estendidos Fig. 3d). Estes dados reforçam múltiplos mecanismos de instabilidade do genoma no TNBC24 que também afetam um subconjunto de ER+ tumores.
Os três arquétipos genômicos replicados em uma coorte independente de 2.229 tumores primários da Genomics England21 (Dados Estendidos Fig. 3e). No geral, a paisagem genômica dos tumores primários de mama se enquadra em um continuum com padrões mutacionais capturados por três arquétipos genômicos principais, a saber, genomas diplóides genômicos estáveis (ER+ enriquecido com risco típico), instabilidade em todo o genoma (enriquecido com TNBC) e amplificações focais e complexas (ER+alto risco + HER2+-enriquecido).
Lesões metastáticas exibem cargas aumentadas de SNV e SV em comparação com tumores primários não pareados, provavelmente devido à terapia, como nós e outros demonstramos13,17 . Usando a abordagem acima, identificamos seis assinaturas SV de novo em metástases que se correlacionaram com aquelas em tumores primários (Figura 4a, b suplementar) e mostraram padrões de enriquecimento específicos de subgrupo semelhantes (Dados Estendidos Fig. 3f). A projeção bidimensional revelou novamente três arquétipos dominantes (Fig. Complementar 4c) que se sobrepõem aos dos tumores primários (Fig. 2b, c, Dados Estendidos Fig. 3g e Fig. Complementar 4d). Nossos resultados foram robustos à escolha do algoritmo de redução de dimensionalidade (Figura 4e-g suplementar). Assim, os três arquétipos genómicos do cancro da mama são conservados na doença metastática.
As assinaturas de SV foram geralmente conservadas, embora aumentadas, em tumores metastáticos, exceto RS4 e RS6 em ER+ alto risco e HER2+ tumores, respectivamente, que eram estáveis (Extended Data Fig. 3h). Estes dados apoiam a ocorrência precoce de rearranjos complexos e a sua persistência através de metástases. Embora a distribuição das assinaturas de CNA refletisse tumores primários, a frente de Pareto revelou aumento da carga de alteração e perfis mais misturados em metástases, consistente com aumento da duplicação do genoma completo e instabilidade genômica17 (Dados Estendidos Fig. 3i e Figura Complementar 4h, i). Assim, os tumores metastáticos retêm as cicatrizes de processos mutacionais específicos de subgrupos que operam na doença em estágio inicial.
Embora o pronto-socorro+tumores de risco típico têm um prognóstico favorável, 29% dos pacientes apresentam recidiva distante4 . Nós investigamos se os arquétipos genômicos melhoram a estratificação de risco. Mapeando METABRIC na frente de Pareto (Métodos, Dados Estendidos Fig. 3j e Fig. Complementar 4j – l), a posição de ER+ tumores de risco típico foram preditivos de recidiva, com tumores recorrentes mapeados mais perto do pronto-socorro+ alto risco + HER2+ arquétipo (Extended Data Fig. 3k, l) acompanhado por um maior escore de perda de heterozigosidade de HRD, histologia de carcinoma lobular invasivo (ILC) e aumento da proliferação.
No METABRIC, os ILCs foram enriquecidos em ER+tumores de risco típico (OR = 2,20, P= 2,27 × 10−3 teste exato de Fisher; Figura Complementar 4m). Dentro do pronto-socorro+ tumores de alto risco, os ILCs exibiram um maior risco de recorrência em 5 anos (39% versus 30%) e risco de recorrência cumulativa (62% versus 54% em 20 anos; Dados Estendidos Fig. 3m). Esta diferença foi mais acentuada entre ER+ tumores de risco típico (55% versus 37% em 20 anos). ILCs estavam mais próximos do pronto-socorro+arquétipo de risco típico do que suas contrapartes de carcinoma ductal invasivo (IDC) (P= 2,10 × 10−5; Dados estendidos Fig. 3n, o) dados seus níveis mais baixos de duplicação do genoma completo, ploidia e fração do genoma alterada. Assim, dadas arquiteturas genômicas comparáveis, a histologia lobular continua sendo uma característica de alto risco.


